
A destilação é um método de separação baseado no fenómeno de equilíbrio líquido-vapor de misturas. Em termos práticos, quando temos duas ou mais substâncias formando uma mistura líquida e homogénea, a destilação pode ser um método para separá-las. Basta apenas que tenham volatilidades razoavelmente diferentes entre si (ou seja, que os seus pontos de ebulição sejam relativamente afastados). É possível também fazer a separação de um líquido volátil de um sólido não volátil.
Um exemplo de destilação que remonta à antiguidade é a destilação de bebidas alcoólicas. A bebida é feita pela condensação dos vapores de álcool que escapam mediante o aquecimento de um mosto fermentado. Como o ponto de ebulição do álcool é menor que o da água presente no mosto, o álcool evapora, dando-se assim a separação da água e o álcool. Um exemplo disto também é a aguardente, com compostos de cana de açúcar, possibilitando a separação devido aos diferentes pontos de ebulição. Outros exemplos são o whisky, conhaque e etc... O vapor que escapa da mistura aquecida é capturado por uma serpentina refrigerada que o devolve ao estado líquido.
O uso da destilação como método de separação disseminou-se pela indústria química moderna. Pode-se encontrá-la em quase todos os processos químicos industriais em fase líquida em que seja necessária uma purificação.
Em teoria, não se pode purificar substâncias até 100% de pureza através da destilação. Para conseguir uma pureza bastante alta, é necessário fazer uma separação química do destilado posteriormente.
A destilação tem as suas limitações, não podendo assim ser aplicada a todos os casos de separação de líquidos.
Destilação é o processo de vaporizar o líquido para depois condensá-lo e recolhê-lo em um outro recipiente
A destilação simples serve para a separação de misturas homogéneas de dois líquidos, podendo também ser usada para a separação de um sólido que se encontra dissolvido num líquido (como por exemplo uma mistura de água e sal).
É importante que os pontos de ebulição das duas substâncias líquidas sejam bastante diferentes (deve existir uma diferença de pelo menos 10º C).
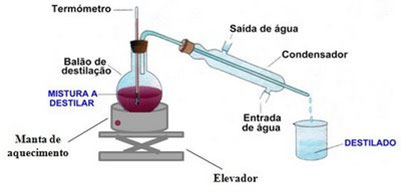
A solução é colocada num balão de destilação (tal como podes ver na figura 2), que depois é aquecido com a ajuda de uma manta de aquecimento. Por vezes também se utiliza um bico de bunsen para o efeito.
A boca do balão é tampada com uma rolha de cortiça perfurada (deve usar-se um furador de rolhas para o efeito), onde se coloca um termómetro.
O balão possui uma saída lateral, inclinada para baixo, na sua parte superior. Quando isso não acontece, como é o caso desta figura, em que se usa um balão de vidro de fundo redondo, deve-se colocar um tubo em vidro que fará chegar o vapor ao condensador.
O condensador possui um tubo interno, onde à sua volta existe uma zona onde circula água fria corrente. Assim o vapor poderá arrefecer e chegar ao gobelé (também chamado béquer ou copo de precipitação).
A solução no balão é aquecida, até que o líquido com menor ponto de ebulição comece a evaporar. Ao evaporar, ele só tem o condensador como caminho a seguir. As paredes do condensador são frias, pois à sua volta passa água fria. Ao entrar em contacto com essas paredes frias, o vapor vai condensar, retornando ao estado líquido.
Após algum tempo, todo o líquido de menor ponto de ebulição terá passado para o gobelé, e sobrará a outra substância (o líquido com maior ponto de ebulição, ou o sólido consoante o caso) no balão de vidro.