
A notação de Lewis, como o próprio nome indica, foi proposta em 1916 pelo físico e químico norte-americano Gilbert Newton Lewis, que nasceu em Massachusetts, a 23 de Outubro de 1875, e que faleceu na Califórnia, a 23 de Março de 1946.
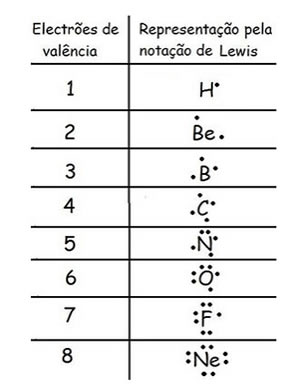
Esta notação consiste numa representação esquemática da camada de valência de cada átomo, isto é, representa-se o símbolo do elemento rodeado dos eletrões de valência (representados por pontos num átomo e por cruzes no outro). Cada ponto ou cada cruz representa um eletrão de valência. Relembra que os eletrões de valência, são os eletrões que estão na última camada de energia.
A notação de Lewis baseia-se na teoria de que certos átomos podem alcançar a estabilidade por partilha de eletrões ficando com uma estrutura estável, igual à de um gás nobre. Esta representação permite prever a formação de ligações químicas entre os átomos. Assim podemos saber se as ligações covalentes, que existem dentro das moléculas são ligações simples, duplas, ou triplas.
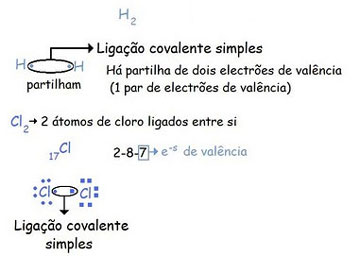
No caso mais simples da molécula de hidrogénio (H2), os dois eletrões, provenientes um de cada átomo, deixam de ser pertença exclusiva de cada um, passando a ser partilhados igualmente pelos núcleos dos dois átomos. É como se cada átomo de hidrogénio tivesse dois eletrões em comum com o outro.
|
Utilizando a notação de Lewis, é possível prever quais as ligações covalentes que existem entre os átomos de uma molécula. Estas ligações podem ser simples, duplas ou triplas. |
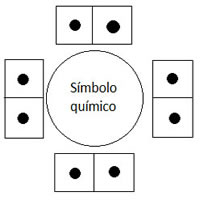
Já vimos que o número máximo de eletrões, na camada de valência é de oito. Para cada um dos átomos deves determinar o número de eletrões de valência e depois distribuir de acordo com a figura.
Por exemplo: Átomo de Oxigénio
O seu número atómico é 8 (procura numa tabela periódica)
Distribuição eletrónica: 2 - 6 (tens que aprender a distribuir os eletrões pelos níveis de energia)
logo, o átomo de oxigénio tem 6 eletrões de valência (são os eletrões do último nível).
Como podes ver na figura 3, no átomo de oxigénio, dois eletrões ficam sozinhos e quatro ficam em pares de 2. Os eletrões que ficam agrupados em pares, chamam-se eletrões não ligantes, pois não participam na ligação química.
Aqueles que ficam sozinhos, têm que se juntar a outros eletrões de um outro átomo, passando a ser partilhados pelos dois átomos ligados entre si.
NOTA: A distribuição dos eletrões em volta do símbolo químico tem de ser sempre pela ordem indicada na figura 3. Os primeiros quatro têm de ficar sozinhos (um em cada canto) e os outros quatro a seguir é que vão fazendo par com os que já lá estão. Observa com atenção todos os exemplos apresentados. Só existem estas possibilidades, pois apenas é possível distribuir oito eletrões de valência.
Vamos ver alguns exemplos de como prever o tipo de ligação covalente nas moléculas, usando a notação de Lewis.
Vamos antes relembrar que as ligações covalentes são ligações químicas onde acontece a partilha de pares de eletrões entre os átomos ligados. As ligações covalentes podem ser simples (partilham um par de eletrões), duplas (partilham dois pares de eletrões) ou triplas(partilham três pares de eletrões).
Como podes observar, na figura 4, onde temos dois exemplos, para a molécula de hidrogénio, apenas ficam sozinhos dois eletrões (pelo que se ligam um ao outro).
Para a molécula de cloro, é necessário fazer a distribuição dos eletrões (Nota que o número atómico do cloro é 17) obtendo-se 7 eletrões de valência. Aqui neste caso também ficam apenas dois eletrões sozinhos (porque os restantes já estão agrupados).
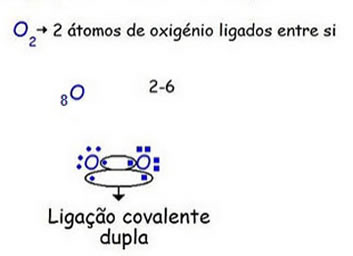
Na figura 5 temos dois pares de eletrões sozinhos, pelo que se ligam dois pares de eletrões, dando origem a uma ligação dupla.
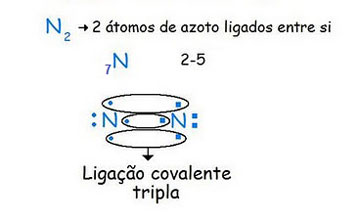
Repara que, no caso da figura 6, sendo o número de eletrões de valência igual a 5 (atenção que o número atómico do azoto é 7), ficaram em cada um dos átomos 3 eletrões sem par, pelo que, juntando-os uns aos outros, obtêm-se uma ligação formada pela partilha de três pares de eletrões - uma ligação covalente tripla.
Experimenta agora prever as ligações covalentes de outras moléculas simples, como o Cl2 (molécula de cloro), o F2 (molécula de Flúor) ou mesmo moléculas com mais átomos, como a água (H2O) ou o dióxido de carbono (CO2).
Podes consultar também:
Manual Texto Editores - "Viver melhor na Terra".